
Der letzte Beitrag in diesem Jahr beschäftigt sich mit der Pharmakogenetik und beantwortet unter anderem die Frage, warum manche Medikamente bei bestimmten Menschen nicht wirken.
Pharmakogenetik – Definition

Pharmakogenetik ist ein relativ neues Teilgebiet der klassischen Pharmakologie.1 Es wird zwischen Pharmakogenomik und Pharmakogenetik unterscheiden: Pharmakogenomik beschreibt die Veränderung des Genexpressionsprofils in Gegenwart von Arzneimitteln, während sich die Pharmakogenetik mit den Ursachen dieser Veränderungen auf Ebene der individuellen genetischen Sequenz eines Organismus beschäftigt.2 Es werden erbliche Besonderheiten von Pharmakokinetik (Was macht der Organismus mit einem Medikament?) und Pharmakodynamik (Was macht ein Medikament mit dem Organismus?) untersucht, mit dem Ziel der Optimierung der Arzneimitteltherapie entsprechend der genetischen Ausstattung des Patienten. Somit vereint die Pharmakogenetik Methoden der klinischen Pharmakologie mit denen der modernen molekularen Genetik.1
Pharmakogenetik – Geschichte
Bereits seit den 1950er Jahren ist bekannt, dass Menschen unterschiedlich auf Medikamente reagieren. Der erste Hinweis darauf lieferte ein für Narkosen verwendetes Muskelrelaxans namens Suxamethionium.3 Hierbei zeigte sich, dass bei 1:3.500 Menschen die Zeit der Narkose stark verlängert war, da das zum Abbau erforderliche Enzym Pseudocholinesterase bei diesen Menschen in geringeren Konzentrationen vorlag.3 Ein weiteres Beispiel, ebenfalls aus den 50er Jahren, zeigte sich bei 10% der Afroamerikaner, die im Koreakrieg kämpften. Diese wurden nach der Einnahme eines bestimmten Antimalariamittels anämisch, was an einer Isoform der Glucose-6-Phosphat-Dehydrogenase lag.2 Aufgrund verschiedener Beobachtungen auf diesem Feld prägte der Humangenetiker Friedrich Vogel bereits 1959 den Begriff Pharmakogenetik.2
Personalisierte Medizin

Einher geht damit die personalisierte Medizin. Diese hat zum Ziel das traditionelle „one-fits-all“ Modell in zielgerichtete Therapien umzuwandeln. Hierfür werden mit Hilfe moderner Diagnostik, individuelle und genetische Informationen verwendet, um für den richtigen Patienten, zur richtigen Zeit, das richtige Medikament, in der richtigen Dosierung zu finden.
Warum wirken Medikamente nicht?
Fehlende Adhärenz
Ein Grund, warum Medikamente nicht wirken, liegt zum einen natürlich am Patienten selbst, der sich nicht an die Therapieempfehlung des Arztes hält.4
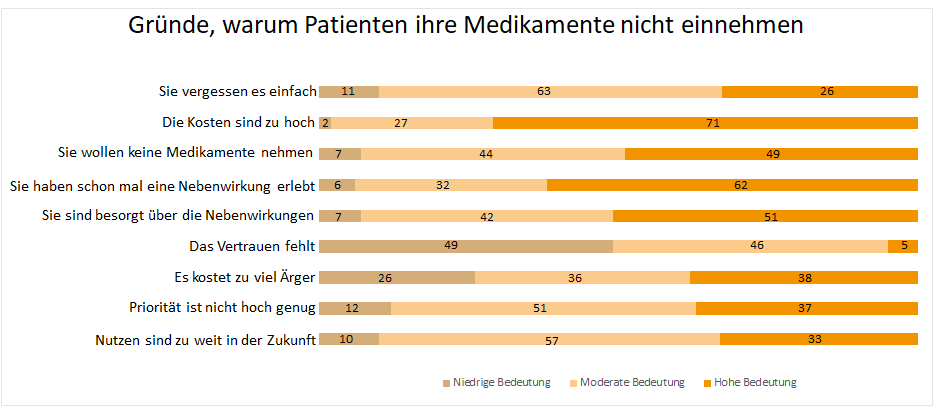
Neben – bzw. Wechselwirkungen

Die wichtigsten Argumente für die Nichtwirksamkeit von Medikamenten, nach den hohen Kosten, sind die Sorgen über Nebenwirkungen bzw. die Angst vor Nebenwirkungen.4 In Deutschland sterben 25.000 bis 58.000 Menschen pro Jahr an Neben – bzw. Wechselwirkungen von Medikamenten.5 In den USA werden jährlich 100.000 Todesfälle verzeichnet und etwa zwei Millionen Patienten klagen über unangenehme Begleiterscheinungen wie Allergien oder Magen-Darm-Probleme.6
Fehlende Evidenzbasis
23% aller Deutschen nehmen drei oder mehr Medikamente pro Tag ein, mit zunehmendem Alter (>70 Jahre) steigt die Anzahl auf knapp 50%.7 Fast ein Drittel dieser Medikamente werden ohne Evidenzbasis verschrieben, das heißt ohne direkten Nachweis über deren tatsächlichen Nutzen.5
Dies wird auch in der Krebstherapie deutlich. Von den 68 Krebsmedikamenten, die zwischen 2009 und 2013 zugelassen wurden, waren 57% ohne wirklichen wissenschaftlichen Beleg darüber, ob diese Medikamente Überlebensvorteile oder eine Verbesserung der Lebensqualität bringen.8 Nach fünf Jahren auf dem Markt hat sich gezeigt, dass sich tatsächlich nur bei 51% therapeutische Vorteile ergaben.8
Responder/Non-Responder
Patienten lassen sich in zwei Gruppen einteilen: in sogenannte „Responder“, bei denen ein bestimmtes Medikament hilft, und in sogenannte „Non-Responder“, bei denen ein Medikament entweder keine Wirkung zeigt oder mit Nebenwirkungen einher geht.9 Ein weiteres Beispiel aus der Krebstherapie macht dies deutlich: 75% aller Krebspatienten werden in die zweite Kategorie eingeteilt, was bedeutet, dass diese Menschen auf die verabreichten Medikamente nicht ansprechen.9 Dies hat zur Folge, dass durch die wirkungslosen Medikamente wertvolle Zeit verloren geht, in der der Krebs sich weiter ausbreitet.9 Durch die auftretenden Nebenwirkungen wird die Lebensqualität der Patienten unnötig beeinträchtigt.9 Außerdem entstehen dadurch enorme Kosten für das Gesundheitssystem, die eigentlich vermeidbar wären.9
Genetik

Mittlerweile ist bekannt, dass ein erheblicher Anteil der Unwirksamkeit von Medikamenten genetisch bedingt ist. „Es gibt sieben Milliarden Menschen. Jeder von ihnen reagiert anders auf ein Medikament“ so Dr. Josef Scheiber, Geschäftsführer und Gründer der BioVariance GmbH. Lebewesen verstoffwechseln Fremdstoffe mit komplexen Enzymsystemen, die von Individuum zu Individuum variieren. Gene, die für potentielle Enzyme kodieren, treten in unterschiedlichen Varianten auf, was als Polymorphismus bezeichnet wird. Verschiedene Varianten eines Gens werden als Allele bezeichnet. Die am häufigsten vorkommende Sequenzvariation ist der Einzelnukleotid-Polymorphismus (single nucleotide polymorphism, SNP), bei dem nur eine einzelne Base unterschiedlich ist. Diese Variation im Genom ist vererbbar und nicht gleichzusetzen mit einer Mutation, die eine neu auftretende Veränderung beschreibt.
Pharmakogenetik – Prinzip
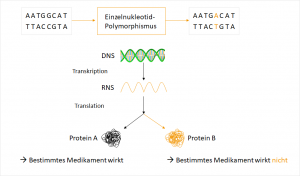
Das zugrunde liegende Prinzip der Pharmakogenetik liegt in diesen kleinen Unterschieden im Erbgut.1 Etwa jeder 1.000 Baustein der insgesamt 3,2 Milliarden Basenpaaren unseres Genoms ist verändert.6 Dies entspricht rund 3 Millionen genetischer Varianten, die uns einzigartig machen.6 Als relevant für pharmakogenetische Überlegungen gelten polymorphe Gene, also Gene mit geringer Abweichung in der Sequenz (Allel), wenn sie mit einer Frequenz von >1% in der Population existieren und mindestens ein Polymorphismus die Aktivität des betroffenen Enzyms ändert.2

Die Wirksamkeit von Arzneimitteln hängt vom entsprechenden Mechanismus des Medikaments, der verabreichten Dosis und der Verstoffwechselung eines Organismus ab.10 Hierbei spielt die Leber eine zentrale Rolle.10 Neben der Produktion von Gallenflüssigkeit, erfüllt diese auch wichtige Funktionen im Stoffwechsel (Metabolismus): zum einen bei Nahrungsmitteln, zum anderen bei Giftstoffen, Drogen oder Arzneimitteln (Biotransformation).10 Die im englischen benutze Abkürzung LADME fasst die Vorgänge, die bei der Aufnahme eines Medikaments passieren, zusammen: Freisetzung, Aufnahme in die Blutbahn, Verteilung, Verstoffwechselung und Ausscheidung.
Als Beispiel dient hier die Cytochrom-P450 Superfamilie. Diese spielt bei der Metabolisierung von Arzneimitteln die wohl bedeutendste Rolle als Monooxygenasen in der Leber.11 CYP2D6 ist am Metabolismus von ca. 25% aller Arzneimittel beteiligt (vor allem Neuroleptika und Antidepressiva).1 Bei dem zugrunde liegenden Gen sind Allele bekannt bei denen die Enzymaktivität vermindert ist, vollständig fehlt oder sogar gesteigert ist.1 Etwa 7% der weißen Bevölkerung sind homozygote Träger des defizienten Allels und besitzen somit keine Aktivität.12 Diese Patienten werden als „Poor Metabolizer“ bezeichnet.12 Eine übliche Dosierung verursacht eine deutlich gesteigerte Arzneimittelreaktion, die im schlimmsten Fall toxisch ist.12 In der Brustkrebstherapie spielt Tamoxifen eine bedeutende Rolle.13 Dieses wird über CYP2D6 zu dem wirksamen Metaboliten Endoxifen aktiviert.13 Jedoch bilden 10% aller Patientinnen dieses Enzym nicht, was bedeutet, dass dieses Medikament bei diesen Patienten nicht wirkt.13 Etwa 1,5 – 5% der Bevölkerung werden als „ultrafast Metabolizer“ bezeichnet.1 Sie weißen eine Genduplikation auf, das bedeutet, diese haben drei aktive Allele und somit eine deutlich gesteigerte Enzymaktivität.1 Eine übliche Dosierung reicht hier nicht aus.1
Therapie

Fortschritte in der molekularen Genetik führen zu einem immer besseren Verständnis bestimmter Erkrankungen und somit Wege zu neuen Therapiemöglichkeiten.2 Ziel ist es, für einen Patienten entsprechend seiner genetischen Ausstattung bzw. den genetischen Merkmalen seiner Erkrankung eine maßgeschneiderte Therapie bereitzustellen und somit die Wirksamkeit und Sicherheit zu verbessern.1 Deswegen werden neben nicht-genetischen Faktoren wie Umwelteinflüsse, die Zusammensetzung der Nahrung, der Lebensstil, das Alter und das Körpergewicht und -größe auch genetische Faktoren berücksichtigt, die für die Variabilität pharmakokinetischer Eigenschaften und Unterschiede in der Wirksamkeit von Arzneimitteln verantwortlich sind.1 Als Ausgangspunkt diente hier das Human Genome Project, welches 2003 für offiziell beendet erklärt wurde.14 Es war ein internationales Forschungsprojekt mit dem Ziel, ein menschliches Genom vollständig zu entschlüsseln, das heißt die Abfolge der rund 3 Milliarden Basenpaare in der menschlichen DNS festzustellen.15 Die daraus gewonnene Erkenntnis dient als Grundlage für die Erforschung vieler biologischer Prozesse wie Erbkrankheiten oder molekulare Mechanismen zur Krebsentstehung.15
Krebstherapie
Auch in der Krebsforschung wurden auf molekularer Ebene große Fortschritte erzielt. Krebs ist nicht wie bisher angenommen wurde, eine Erkrankung eines Organes, sondern vielmehr eine Erkrankung des Genoms. Diese kommt durch Veränderung eines oder mehrerer Gene zustande.16 Somit ist Krebs nicht gleich Krebs, da der Mensch um die 25.000 Gene hat, von denen nach heutigem Wissensstand um die 300 krebsrelevant sind.16
Die negative Seite der bisherigen Krebstherapie ist allgemein bekannt. Durch die Verabreichung von Zytostatika werden nicht nur Krebszellen vernichtet, sondern auch die gesunden Körperzellen angegriffen, was schwerwiegende Folgen mit sich bringt. Zusätzlich zeigen rund 51% der eingesetzten Zytostatika nicht den erwartenden Erfolg.8 Standen bis zum Jahr 2000 nur Operation, Bestrahlung und Chemotherapie im Kampf gegen den Krebs zur Verfügung, werden durch die personalisierte Medizin neue Möglichkeiten geschaffen. Sowohl in Deutschland als auch in den USA ist Krebs nach wie vor die zweithäufigste Todesursache.17 Zusätzlich wird die Anzahl derer, die neu an Krebs erkranken von Jahr zu Jahr höher. Dieses Jahr wird damit gerechnet, dass in Deutschland 493.600 neue Krebsfälle hinzukommen, weltweit wird auf 18,1 Millionen geschätzt.18,19 Prognosen sagen voraus, dass dieser Wert bis 2030 auf 21,6 Millionen und bis 2040 auf 29,4 Millionen ansteigen wird.20,21
Zusammenfassung
Bisher entschieden Ärzte sich aufgrund ihres Wissens über Krankheiten, ihrer Erfahrung mit Medikamenten und der Patientendaten für eine bestimmte Therapie. Wirkte diese nicht oder nur schlecht, wurde eine andere Dosis oder ein anderes Medikament ausgewählt.22 Mit der personalisierten Medizin entsteht nun die Möglichkeit einer idealen Behandlung. Vorteile ergeben sich dadurch sowohl für den Patienten, als auch für die Ärzte und Unternehmen im Gesundheitswesen:

Jedoch steht nicht nur die ideale Therapie im Vordergrund, sondern auch die Möglichkeit der präziseren Diagnosen.22 Zusammenfassend lässt sich sagen, dass das Finden unterschiedlicher Krankheitsursachen und die Behandlung dementsprechend und auf den Patienten spezifisch anzupassen, das Ziel der personalisierten Medizin ist.
Ansprechpartner:
Kristina Schraml (kristina.schraml@biovariance.com)



