Die Problematik
Grundsätzlich dürfen nur Arzneimittel herausgegeben werden, die von entsprechenden Arzneimittelbehörden auf ihre Sicherheit, Wirksamkeit und Qualität geprüft und für die entsprechenden Indikationen zugelassen wurden. Der Begriff „Off-Label-Use“ bezieht sich allgemein auf den Gebrauch von Arzneimitteln außerhalb der vorgesehenen Anwendung. [1] Die insoweit relevanten Aspekte der Zulassung sind das Anwendungsgebiet und die Darreichungsform, aber auch Anwendungsmodalitäten wie Dosierung, Einnahmezeitpunkt und Behandlungsdauer. Off-Label-Use ist grundsätzlich nicht verboten, bedarf jedoch besonderer Sorgfalts- und Aufklärungspflichten. Allgemeine Risiken wie beispielweise eine verminderte Wirksamkeit oder Nebenwirkungen sind hier oft schwerer absehbar als beim bestimmungsgemäßen Gebrauch, weil aussagekräftige Studienergebnisse zur Wirksamkeit und Therapiesicherheit fehlen. [1,2] Bei Neugeborenen liegt der Off-Label-Gebrauch bei über 90 %, bei Kindern sind es teilweise bis zu 50 % der Patienten, und bei den Erwachsenen treffen unzulässige Medikationen immerhin noch in etwa 25 % Fälle zu. [3,4] Die Gründe für eine nicht-regelkonforme Anwendung sind vielfältig. Die Kostenübernahme eines nicht zugelassenen Medikaments durch die gesetzliche Krankenkasse ist nur unter strengen Kriterien möglich: [1]
- Schwerwiegende oder lebensbedrohliche Erkrankung
- Begründete Aussicht, dass mit dem betreffenden Präparat ein Behandlungserfolg erzielt werden kann
- Fehlende andere Therapiemöglichkeiten
Off-Label-Use in der Pädiatrie
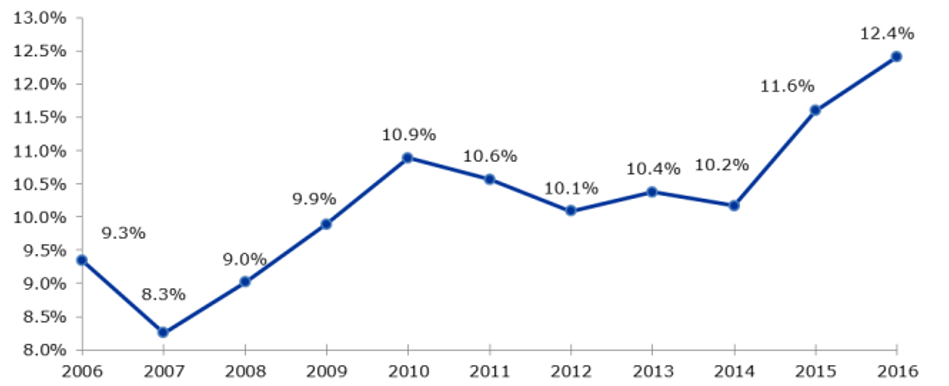
Gerade in der Pädiatrie ist der Off-Label-Einsatz verbreitet, da klinische Studien zur Anwendung von Arzneimitteln an jungen Patienten oft fehlen. Kinder und Jugendliche unterscheiden sich in Körpergröße und -funktionen altersabhängig voneinander und von Erwachsenen, weshalb die Verschreibung von Medikamenten, die eigentlich nur für Erwachsene getestet und zugelassen sind, das Risiko einer Über- oder Unterdosierung oder unerwarteter Nebenwirkungen birgt. [2,5] Da kranke Kinder aber dennoch auf eine ausreichende Behandlung angewiesen sind, müssen sich die behandelnden Ärzte trotz fehlender Studiendaten in diesem gesetzlichen Graubereich bewegen. Bei der klinischen Forschung mit Kindern sind beispielsweise besondere ethische und rechtliche Aspekte zu beachten. Für die Teilnahme an einer klinischen Studie ist die Einwilligung der Patienten (bei Kindern entwicklungsabhängig ab 8 Jahren) und der gesetzlichen Vertreter notwendig. Im Gegensatz zu klinischen Studien an Erwachsenen darf dabei keine finanzielle Entschädigung für die Studienteilnahme angeboten werden. Bei seltenen Krankheiten werden einzelne Indikationen zudem nie einen vollen Zulassungsstatus erreichen, da die Anzahl der Patienten vor allem in der jeweiligen Altersgruppe zu klein ist, um überhaupt klinische Studien durchführen zu können. [5] Um die Versorgungslage von Kindern und Jugendlichen in Hinblick auf zugelassene Arzneimittel zu verbessern erließ die EU schließlich im Jahr 2007 die Verordnung (EC) Nr. 1901/2006 mit dem Ziel, die Anzahl zugelassener Arzneimittel mit pädiatrischer Indikation für Patienten im Alter von 0–17 Jahren zu erhalten und zu erweitern. [6] Im Zuge dessen wurde der Pädiatrie-Ausschuss der Europäischen Arzneimittel-Agentur (EMA) etabliert, dessen Hauptaufgabe die Validierung pädiatrischer Prüfkonzepte von Arzneimittelherstellern ist. Seit der Implementierung der Verordnung wurden pädiatrische Studien verstärkt durchgeführt, wodurch etwa 100 neue Indikationen autorisiert und über 270 neue Medikamente für die Therapie von Kindern zugelassen wurden (siehe Abb. 1). [2,7]
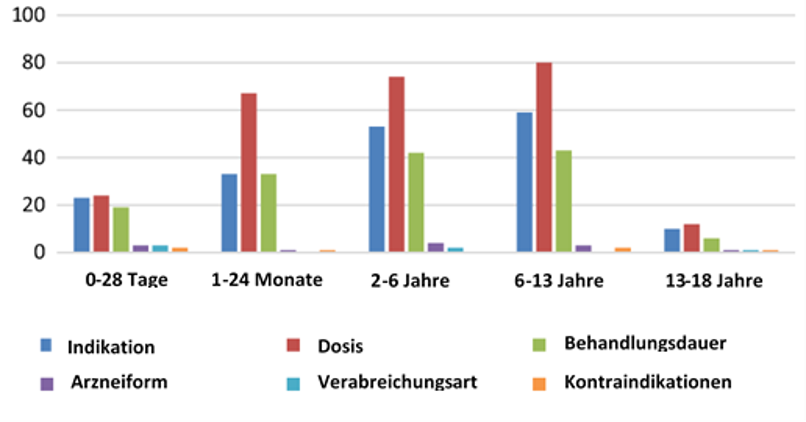
Besonders viele Off-Label-Verschreibungen wurden im Jahr 2016 bei Patienten zwischen dem 1. und 13. Lebensjahr verzeichnet, wobei die höchsten Zahlen in der Altersgruppe von 6-13 Jahren vermerkt wurden. Dies betraf vor allem die Dosierung der Medikamente, die Wahl der entsprechenden Medikation in Bezug auf die Krankheit des Patienten sowie die festgelegte Dauer der Behandlung (siehe Abb. 2). [8]
Fortschritt durch Digitalisierung
Aufgrund der Problematik des oftmals nötigen Off-Label-Einsatzes in der Pädiatrie wurden bereits in verschiedenen europäischen Ländern Projekte zur Entwicklung von Online-Datenbanken verwirklicht, die die Ärzte bei der Behandlung ihrer jungen Patienten unterstützen sollen. Dazu gehören das „Kinderformularium“ aus den Niederlanden, das „British National Formulary for Children“ aus England, das „Kispiportal“ aus der Schweiz und die „Drugbase“ aus Deutschland. [9,10,11,12]
- Das „Kinderformularium“ ist eine öffentlich zugängliche Datenbank und stellt primär ein Nachschlagewerk für Apotheker und Fachärzte der Kinder- und Jugendmedizin dar. Aktuell können 730 Arzneimittel mit Informationen zu Dosierungen, Darreichungsformen, Nebenwirkungen, Kontraindikationen und entsprechende Referenzen nachgeschlagen werden. [9]
- Das „British National Formulary for Children“, welches vom Royal College of Paediatrics and Child Health (RCPCH) in Kooperation mit der Neonatal and Paediatric Pharmacists Group (NPPG) gestaltet wird, richtet sich an Gesundheitsexperten und bietet Informationen rund um die Verschreibung und Versorgung von Arzneimitteln für Kinder und Jugendliche an. Es umfasst mittlerweile mehr als 900 Arzneimittel und über 200 Behandlungsoptionen. [10]
- Das „Kispiportal“ ist eine Datenbank des Universitäts-Kinderspitals Zürich. Nach Eingabe von Patientendaten werden Informationen zur korrekten Dosierung eines bestimmten Arzneimittels automatisch ermittelt. [11]
- Die „Drugbase“ umfasst diverse Nachschlagewerke im Bereich der Medizin und Pharmazie wie beispielsweise die Rote Liste, Arzneimittelprofile oder pädiatrische Dosistabellen, die alle von der Wissenschaftlichen Verlagsgesellschaft Stuttgart angeboten werden. [12]
Mit diesen umfangreichen und sofort abrufbaren Datengrundlagen sollen nun auch für die Jüngsten unserer Gesellschaft bei zukünftigen Therapien nicht nur Nebenwirkungen vermieden und Therapiekosten gesenkt werden, sondern auch eine möglichst kurze Behandlungsdauer und damit auch ein schnellerer Weg zurück in ein gesundes Leben ermöglicht werden. Ansprechpartner: Kerstin Hammer Quellen




